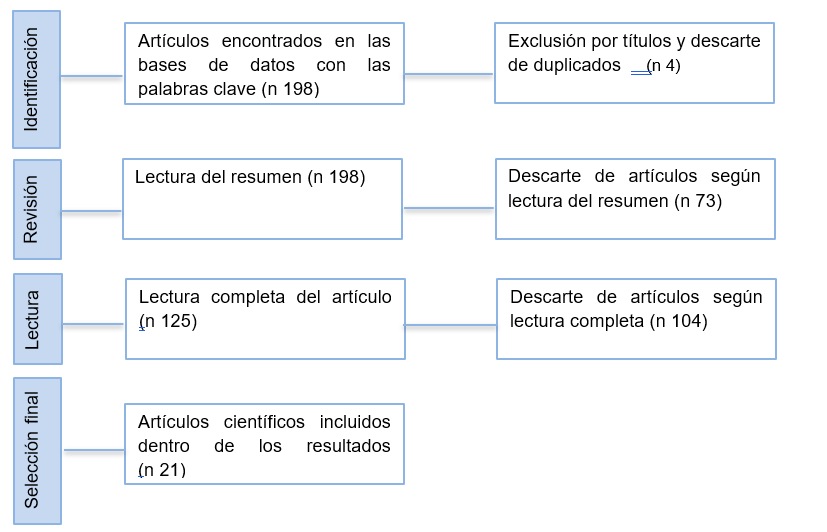
Figura 1. Diagrama de flujo de identificación y selección de los artículos
Fuente: elaboración propia, 2024.
Resultados y discusión
Resultados de la electrococleografía en pacientes con desorden del espectro de neuropatía auditiva
Las medidas objetivas electrofisiológicas, evalúan la funcionalidad de las células del oído interno y la vía auditiva (VA), esto permite diferenciar los trastornos auditivos con origen coclear o retrococlear14.
Dentro de la función anormal del VIII par craneal, se encuentran clasificadas las lesiones presinápticas con afectación en las células ciliadas internas (CCI) y su sinapsis y las postsinápticas con afectación en las dendritas, ganglios y axones del nervio, por razones hereditarias, infecciosas, metabólicas o inmunitarias15, 16, 17.
Con la ECoG se pueden buscar las respuestas de los MC, que son potenciales eléctricos generados por la cóclea ante los estímulos sonoros y su utilidad está en que las EOA que estarían presentes, pueden desaparecer con el tiempo, pero los MC no18.
Asimismo, refleja un PS a los 0,8ms después de presentado el estímulo como la respuesta bioeléctrica de la actividad de las células ciliadas externas y las CCI, así como el PAC a 1,65 ms para distinguir si la lesión es presináptica o postsináptica.
Esto se puede definir con la presencia o ausencia tanto del potencial de sumación (PS) como la alteración del potencial de acción compuesto (PAC en la ECoG. En la tabla 1 se exponen los distintos resultados que podemos obtener con esta prueba, según el sitio de la lesión16, 19.
La tabla 1 sintetiza que en algunas neuropatías se ven afectados los axones de las células nerviosas y el tronco encefálico, pero no las células ciliadas de la cóclea. De manera que en la ECoG se puede observar la presencia del PS, pero ausencia o alteración del PAC.
Por otro lado, se puede observar un trastorno en las células del ganglio donde en la ECoG hay presencia del PS, lo que confirma la adecuada funcionalidad de las CCI, pero un PAC ausente o muy reducido en amplitud. Tal como es el caso del DENA por causa de hiperbilirrubinemia19.
Curet19 señala que respecto a la afectación en la conducción de la estimulación a través del NA, en zonas más altas, lo que se observa con alteración son las ondas III y V de los PEATC o con amplias latencias. Un ejemplo de ellos es la esclerosis múltiple o tumores del ángulo ponto cerebeloso.
Tabla 1. Resultados de las pruebas electrofisiológicas en desorden del espectro de neuropatía auditiva según el sitio de la lesión
|
Autor |
Sitio de la lesión |
Etiología |
Localización |
Prueba |
|||
|
MC |
PS |
PAC |
PEATC |
||||
|
Rance y Starr14 |
Presináptica |
Hipoxia |
Células Ciliadas Internas: Receptor presináptico |
Normal |
Anormal |
Anormal |
Anormal |
|
Vona et al20 |
Presináptica |
Gen de otoferlina |
Trastorno sináptico |
Normal |
Normal |
Anormal |
Anormal |
|
Santarelli et al21 |
Postsináptica |
Gen atrofia óptica tipo I |
Dendritas |
Normal |
Normal |
Anormal |
Anormal |
|
Saidia et al15 |
Postsináptica |
Ataxia de Friedrieich y Charcot Marie Tooth 2 |
Dendritas y axones |
Normal |
Normal |
Anormal |
Anormal |
|
Curet19 |
Postsináptica |
Hiperbilirrubine-mia |
Células ganglionares |
Normal |
Normal |
Anormal |
Anormal |
|
|
|
Síndrome de ataxia cerebelosa-arreflexia-pies cavos-atrofia óptica-hipoacusia neurosensorial |
|
|
|
|
|
|
Anzalone et al23 |
Postsináptica |
Charcot Marie Tooth 1 |
Vaina de mielina |
Normal |
Normal |
Anormal |
Anormal |
|
Rance y Starr14 |
Postsináptica |
Malformación del Nervio Auditivo |
Nervio auditivo |
Normal |
Normal |
Ausente |
Ausente |
Fuente: elaboración propia basada en Rance y Starr14, Vona et al20, Santarelli et al21, Saidia et al15, Curet19, Santos et al22, Anzalone et al23.
MC: microfónicos cocleares; PS: potencial de sumación; PAC: potencial de acción compuesto; PEATC: potenciales evocados auditivos de tallo cerebral.
Así mismo Curet19 informa que, en su estudio de 11 pacientes usuarios de IC con DENA, tuvieron mejores resultados del IC los que tenían mutación del gen OTOF, en cuanto a detección del sonido y habilidades comunicativas. En la ECoG se observó presencia de PS, un PAC ancho por el retraso en a la velocidad de conducción del estímulo por el axón, y los PEATC alterados19.
En cuanto a los resultados del estudio de Martínez del Rio24, se describe el caso de una paciente de 6 años, que fue prematura del Hospital Universitario Río Hortega de Valladolid, con PEATC ausentes y EOA y MC presentes, a la que se le detectó alteración del gen OTOF, se le realizó el IC24.
Por su parte Rance y Starr14 relatan el caso de un individuo con hipoacusia neurosensorial y DENA en oído derecho. Las pruebas electrofisiológicas de PEATC se reflejan presencia de onda I y ausencia de ondas III y V a 90 dBnHL con estímulo click, MC presentes y EOA presentes, y PS alterado en la ECoG, lo cual confirmó el diagnóstico de DENA y que la lesión es de origen presináptico.
De igual manera describen a un paciente con Ataxia de Friedreich con alteración progresiva de los PEA, el PAC, pero con presencia de MC y PS en la ECoG, y con EOA presentes. Y otro con Charcot Marie Tooth con características similares a las del paciente anterior en sus pruebas electrofisiológicas14.
En un estudio de Santos et al22 sobre el Síndrome de CAPOS, se describen los hallazgos fenotípicos y genotípicos de 3 miembros de una familia española con dicho síndrome, en la cual el menor de 10 años tiene tratamiento con IC. En los PEATC no se observó onda V a 90 dBnHL, en la ECoG se observa PS y PAC normal, presencia de EOA bilateralmente, hipoacusia neurosensorial moderada bilateral con discriminación de 60%, lo cual evidenció el DENA.
Beneficios del implante coclear según los resultados obtenidos en la electrococleografía en pacientes con desorden del espectro de neuropatía auditiva
La rehabilitación auditiva en personas con DENA ha sido un tema con opiniones muy controversiales, mientras que unos apoyan la idea del IC en la mayoría de los casos, otros no14.
Como parte del apoyo al uso de los audífonos, se sugiere la comunicación en ambientes acústicamente controlados, sin embargo, esto es algo con mucha complejidad. Por esta razón se utilizan herramientas como sistemas de frecuencia modulada, los cuales permiten hacer un manejo de la relación señal ruido, y el paciente escucha directamente los sonidos del lenguaje en los audífonos o implantes. Esto ha beneficiado grandemente a los usuarios, principalmente para obtener buenos rendimientos académicos14.
Respecto al IC, el estudio topográfico de la lesión nos brinda un pronóstico más realista de su beneficio, por cuanto si la lesión es presináptica los resultados son muy buenos, pero en caso de lesiones postsinápticas los resultados mejoran solo parcialmente el procesamiento auditivo17.
Aun así, actualmente el IC es una elección de tratamiento para la rehabilitación de pacientes con DENA por parte de los otorrinolaringólogos y audiólogos, a pesar de que los resultados son variables entre un paciente y otro25, tal como se muestra en la tabla 214.
Muchos pacientes con DENA se han beneficiado logrando una adecuada comprensión y desarrollo del lenguaje verbal, y para otros el procesamiento en ambientes competitivos y con desafíos temporales de la señal acústica, ha sido todo un reto, no logrando una audición funcionalmente útil. Esto debido a que el beneficio del IC en pacientes con DENA, está estrechamente relacionada con el topodiagnóstico del lugar de la lesión14.
Saidia et al15 indican que actualmente está la opción de rehabilitación auditiva con los audífonos. Respecto al IC, su beneficio va a depender directamente del lugar de la lesión.
Rance y Starr14 indican que, en el caso de las lesiones presinápticas, los pacientes con IC han mostrado un adecuado beneficio, por ejemplo, los pacientes diagnosticados con DENA por la etiología Kernicterius por hiperbilirrubinemia perinatal, tienen un 50% con beneficio con el IC y un adecuado desarrollo del lenguaje, caso contrario en aquellos pacientes cuya lesión es postsináptica, en donde los resultados de la implantación son muy variables y con pocos beneficios. De ahí la importancia del abordaje individual de cada caso.
Tabla 2. Beneficios del implante coclear según los resultados de la electrococleografía en pacientes con desorden del espectro de neuropatía auditiva
|
Autor |
Sitio de la lesión |
Etiología |
Localización |
Beneficio |
|
Rance y Starr14 |
Presináptica |
Hipoxia |
Células Ciliadas Internas: Receptor presináptico |
Con beneficio comprobado en habilidades de comunicación y detección del sonido |
|
Curet19 |
Presináptica |
Gen de otoferlina |
Trastorno sináptico |
Con beneficio comprobado en habilidades de comunicación y detección del sonido |
|
|
|
|
|
Se benefician en caso de los pacientes con mutación en el gen OTOF, pero escasamente los pacientes con problemas en las dendritas de las células ganglionares. |
|
Anzalone et al23 |
Postsináptica |
Ataxia de Friedrieich Charcot Marie Tooth 2 |
Dendritas y axones |
Sin beneficio, su candidatura a IC debe manejarse con precaución |
|
Rance y Starr14 |
Postsináptica |
Hiperbilirrubinemia |
Células ganglionares |
50% con beneficio y 50% sin beneficio. |
|
|
|
Síndrome de ataxia cerebelosa-arreflexia-pies cavos-atrofia óptica-hipoacusia neurosensorial |
|
|
|
Anzalone et al23 |
Postsináptica |
Charcot Marie Tooth 1 |
Vaina de mielina |
Sin beneficio, su candidatura a IC debe manejarse con precaución |
|
Vandana et al27 |
Postsináptica |
Enfermedad de Refsum |
Neurona auditiva de primera orden |
50% con beneficio y 50% sin beneficio. |
|
Rance y Starr14 |
Postsináptica |
Malformación del Nervio Auditivo |
Nervio auditivo |
Nulo, no hay transmisión del estímulo hacia corteza cerebral |
Fuente: elaboración propia basada en Rance y Starr14, Curet19, Tekin et al26, Anzalone et al23, Santos et al22, Vandana et al27.
Curet19 es enfático cuando aclara que, respecto al beneficio del IC continua en investigación y clasifica a los pacientes en dos grupos: (1) pacientes con lesión distal al ganglio de Corti en el cual se observó lesión en sinapsis de CCI y dendritas del VIII par craneal y otros con lesión en CCI, pero no en ganglio; y (2) pacientes con lesión proximal al ganglio de Corti en el cual se vieron afectadas las células ganglionares, pero con integridad en CCE y CCI.
Esto lo confirma Manrique et al28, quien afirma que el IC aporta resultados variables, ya que su beneficio depende del sitio de la lesión.
Zhen y Liu29 informan sobre un estudio de 10 pacientes con OTOF quienes fueron beneficiarios de IC y se consideraron exitosos, con mejoría en la percepción y reconocimiento del habla, y mejor aun cuando se implantan a edades muy tempranas.
Martínez del Río24 indica que, durante el tiempo postnatal, el período de plasticidad cerebral hace que la corteza auditiva sea más sensible a la estimulación auditiva, y, por ende, al desarrollo del lenguaje. Destaca que, en un estudio retrospectivo realizado en el 2014, de niños con DENA, se concluye que los implantados a edades tempranas antes de los 2 años, tienen mejor capacidad de desarrollo de audición y lenguaje que los implantados a edades más tardía.
Otro estudio del 2015 del Hospital for Sick Children en Toronto, concluye que recibieron mejor beneficio del IC los niños implantados diagnosticados con DENA antes de los 5 años que los que se implantaron después24.
En un estudio realizado con 36 niños implantados entre el 2001 y 2021, con alteración en el gen OTOF y OPA I, mostraron mejorías en el desarrollo del lenguaje29.
En el estudio de Santos et al22, los 3 casos de una madre de 40 años, su hijo mayor de 11 años y su hijo menor de 10 años con síndrome de CAPOS, este último con año y medio de uso de IC demostró un gran beneficio en cuanto a pruebas audiológicas y logopédicas, favoreciendo su desarrollo psicosocial y académico.
Por su parte, Anzalone et al23 muestran el caso de un hombre de 70 años con síndrome de Charcot Marie Tooth, que fue remitido al programa de IC por HNS asimétrica que había progresado en 15 años. Se le realizó el implante en el oído izquierdo que era el más afectado, sin embargo, el progreso en la percepción del habla fue de 0% a 32% y 53% en la prueba de fonemas, por esto se concluyó en este estudio que el ritmo de progresión de estos pacientes con IC es muy gradual, por lo cual debe tomarse en consideración con sumo cuidado.
Respecto a esta enfermedad de Charcot Marie Tooth, en un estudio realizado por Goswamy J et al30, se describe el caso de un hombre de 67 años con disminución gradual pero significativa de su audición como parte de la neuropatía periférica, quien tenía una discriminación del lenguaje de 0% en entornos abiertos y se trató con IC. Se le realizaron evaluaciones de comprensión del habla en espacios abiertos, con resultado de un progreso más lento que le promedio de pacientes con IC30.
En relación con la enfermedad de Refsum, en un estudio publicado en el 2017 por Stähr et al31 de dos hermanos de 56 y 61 años que fueron implantados, tuvieron una mejor percepción de palabras bisilábicas, pero no así en los monosílabos, en el seguimiento de estos podría presentarse todavía un mayor deterioro a largo plazo por la degeneración retrococlear.
Esto al contrario de otro paciente de 59 años con esta enfermedad implantado bilateralmente, estudiado por Nogueira32 quien, si obtuvo buenos resultados, lo cual indica que algunos pacientes con este síndrome podrían presentar lesiones a nivel presináptico.
Asimismo, en otros estudios se considera la edad de la implantación, Xin et al25 realizaron un estudio de 283 niños sordos prelocutivos, revelaron la importancia de la implantación a temprana edad siempre que se cumplan los criterios de candidatura, pero da énfasis a la contraindicación absoluta en los pacientes que tienen aplasia o hipoplasia del NA.
En este sentido Kontorinis et al33 aclaran que se descarta totalmente la posibilidad de un IC en pacientes con malformación anatómica, tal como la displasia del NA, debido a que es muy diferente al DENA que supone solamente un desorden funcional pero no anatómico.
El DENA es una patología para diagnosticar con sumo cuidado, siguiendo correctamente todos los protocolos, debido a la discusión del beneficio del IC, el cual depende de la edad de la implantación y del topo-diagnóstico.
Conclusiones
Se cuenta con información importante en cuanto al comportamiento del DENA según el sitio de lesión y en cómo afecta directamente al paciente a la hora de colocarle un IC.
La ECoG tiene gran utilidad para el diagnóstico y rehabilitación de pacientes con DENA candidatos a IC, por esta razón es una prueba que se realiza en otros países de manera indispensable. En nuestro país, se cuenta con todos los recursos para aplicar la prueba a todos los pacientes con esta patología y de esta forma disponer de las herramientas necesarias para darles un acompañamiento más integral.
El DENA es una patología para diagnosticar con sumo cuidado, siguiendo correctamente todos los protocolos, debido a la discusión del beneficio del IC, el cual depende de la edad de la implantación y del topodiagnóstico.
A la fecha se genera controversia, debido a que los profesionales en la salud auditiva como audiólogos y otorrinolaringólogos no siempre coinciden en los criterios sobre su abordaje y rendimiento de la rehabilitación, debido a que los resultados de esta son muy variables de un paciente a otro.
Generalmente, junto con la decisión de colocar un IC, vienen las expectativas del paciente y de la familia de tener una mejora significativa en cuanto a discriminación de sonidos y la comunicación. Como se resaltó en esta revisión, no todos los pacientes con DENA llegan a obtener el benefició esperado, y por ende no se cumplen las expectativas de rehabilitación.
El manejo pre y postoperatorio de estas expectativas del paciente y su familia es crucial, y se puede tener un mejor manejo o abordaje al conocer con totalidad el sitio de lesión de la patología, de forma que se tenga claro cómo es su pérdida auditiva, sus repercusiones en su comunicación y las posibilidades terapéuticas más idóneas.
La recomendación es fomentar la aplicación de la ECoG en todos los pacientes con DENA que sean candidatos a IC. Se logró demostrar que esta prueba tiene un gran aporte en cuanto al diagnóstico del DENA, así como también en la identificación de la zona afectada.
Referencias bibliográficas
1.
- Organización Mundial de la Salud [Internet]. Suiza:la Organización; 2024.. Sordera y pérdida de la audición. [aprox. 7 pantallas]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/deafness-and-hearing-loss#:~:text=P%C3%A9rdida%20de%20audici%C3%B3n%20y%20sordera,%2C%20moderada%2C%20grave%20o%20profunda.
- American Speech Languaje Hearing Association. Tipo, grado y configuración de la pérdida de audición [Internet]. Estados Unidos:ASHA;2023. Disponible en: https://www.asha.org/siteassets/ais/ais-type-degree-and-configuration-of-hearing-loss-spanish.pdf?srsltid=AfmBOoou_g9hRBEmKyFNYzyyBFlVz5jKpEyoOlCBppiEkQ3QCgD05GMF
- Núñez F, Jáudenes C, Sequí JM, Vivanco A, Zubicaray J, Olleta I. Actualización de los programas de detección precoz de la sordera infantil: recomendaciones CODEPEH2019 (Niveles 2,3 y 4: diagnóstico, tratamiento y seguimiento). Rev Esp Discapac[Internet]. 2020;8(1):219-246. Disponible en: https://www.cedid.es/redis/index.php/redis/article/view/664
- Chaverri J. El Implante Coclear: sus indicaciones. Acta Med Costarric [Internet]. 201860(3):132-135. doi:51481/amc.v60i3.1008
- Valverde Manual de Protocolo para la Colocación de un Implante Coclear. [Tesis de Maestría en Otorrinolaringología y Cirugía de Cabeza y Cuello]. Costa Rica:Universidad de Costa Rica;2015. Disponible en: https://repositorio.sibdi.ucr.ac.cr/items/be058260-4ded-4acd-aa6a-58fd6437e579
- Sanz R, Martín E,. Exploración Otoneurológica.Interpretación de las pruebas vestibulares. Abordaje práctico del paciente con vértigo y alteraciones del equilibrio. [Internet]. 1a ed.. España:Amplifon Ibérica;2016.. Disponible en: https://www.researchgate.net/profile/EduardoMartinSanz/publication/319091678_Exploracion_Otoneurologica_Interpretaciondelaspruebasvestibulares/links/599016df458515b87b4a6664/ExploracionOtoneurologicaInterpretaciondelaspruebasvestibulares.pdf
- Moser T, Starr A. Auditory neuropathy-neural and synaptic mechanisms. Nat Rev Neurol [Internet]. 2016;12:135-149. doi: 10.1038/nrneurol.2016.10
- Rubio-Partida G, Celis-Aguilar E, Verdiales-Lugo S, Castro-Urquizo A, De la Mora-Fernández A, Coutinho-de Toledo H. Neuropatía auditiva en México: la importancia de realizar potenciales auditivos de tallo. An Orl Mex [Internet]. 2020;65(3):137-146. Disponible en: https://www.medigraphic.com/pdfs/anaotomex/aom-2020/aom203d.pdf
- Shearer A, Hansen M. Auditory synaptopathy, auditory neuropathy, and cochlear implantation. Laryngoscope Investig Otolaryngol[Internet]. 2019;4(4): 429-440. doi: 10.1002/lio2.288
- Rodríguez M, Algarra J. Audiología [Internet]. España: SEORL Sociedad Española de Otorrinolaringología y Patología Cérvico-Facial;2014. Disponible en: https://es.slideshare.net/ssuser5c95731/2014-audiologiapdf
- Asociación Colombiana de Otorrinolaringología, Cirugía de Cabeza y Cuello Maxilofacial y Estética Facial. Esbozo preliminar de una guía para el diagnóstico y manejo de la neuropatía auditiva [Internet]. encolombia.com. 2014 [citado 13 enero 2025]. Disponible en: https://encolombia.com/medicina/revistas-medicas/aoccc/vsuple-302/otorrino30202supl-esbozo/
- Fontenot T, Giardina CK, Teagle HF, Park LR, Adunka OF, Buchman CA, et al. Clinical role of electrocochleography in children with auditory neuropathy spectrum disorder. Int J Pediatr Otorhinolaryngol [Internet]. 2017;99:120-127. doi: 1016/j.ijporl.2017.05.026
- Rico-Romero B, Gutiérrez-Farfán I, Alonso L. Reporte de un caso con trastorno en el espectro de la neuropatía auditiva (DENA). Rev Mex Comun Audiol otoneurol Foniatr [Internet]. 2015;4(1):32-39. Disponible en:https://www.medigraphic.com/pdfs/audiologia/fon-2015/fon151e.pdf
- Rance G, Starr A. Pathophysiological mechanisms and functional hearing consequences of auditory neuropathy. Brain [Internet]. 2015;138(11):3141-3158. doi:10.1093/brain/awv270
- Saidia A, Ruel J, Bahloul A, Chaix B, Venail F, Wang J. Current Advances in Gene Therapies of Genetic Auditory Neuropathy Spectrum Disorder. J Clin Med [Internet]. 2023;12(3):1-19. doi: 3390/jcm12030738
- Luryi A, Schutt C. Electrocochleography. En: Babu S, Schutt C, Bojrab D, editores. Diagnosis and Treatment of Vestibular Disorders [Internet]. Alemania:Springer;2019.113-125. Disponible en: https://doi.org/10.1007/978-3-319-97858-1_9
- Lirola-Delgado A. Neuropatías Auditivas. Rev Soc Otorrinolaringol Castilla Leon Cantab La Rioja [Internet]. 2014;5(25):207-211. Disponible en: https://gredos.usal.es/bitstream/handle/10366/124557/revistaorl201425_neuropatiaauditiva?sequence=1
- Do Amaral I, De Lemos P, Tenorio A, Lira KC, Gomes O. Study of cochlear microphonic potentials in auditory neuropathy. Braz J Otorhinolaryngol [Internet]. 2016;82(6):722-736. doi: 1016/j.bjorl.2015.11.022
- Curet C. Implante coclear y neuropatía auditiva. Desincronización auditiva. Rev FASO [Internet]. 2012;19(1):58-62. Disponible en: http://faso.org.ar/revistas/2012/1/11.pdf
- Vona B, Rad A, Reisinger E. The Many Faces of DFNB9: Relating OTOF Variants to Hearing Impairment. Genes [Internet]. 2020;11(12):1411. doi: 3390/genes11121411
- Santarelli R, Rossi R, Scimemi P, Cama E, Valentino M, La Morgia Ch, et al. OPA1-related auditory neuropathy: site of lesion and outcome of cochlear implantation. Brain [Internet]. 2015;138(3):563-576. doi:1093/brain/awu378
- Santos S, Pradillo E, Duat A, González N, Cervera J, Bartolomé M. Neuropatía Auditiva en síndrome de capos pediátrico: Evolución favorable con implante coclear. Rev Port Otorrinolaringol Cir Cabeça Pescoço [Internet]. 2019 ;57(3):121-125. doi: 34631/sporl.737
- Anzalone L, Nuhanovic S, Olund A, Carlson M. Cochlear Implantation in Charcot-Marie-Tooth Disease: Case Report and Review of the Literature. Hindawi Case Rep Med [Internet]. 2018; 2018(1):1-3. doi: 1155/2018/1760978
- Martínez Del Río, C. Implante coclear: Posible tratamiento para la neuropatía auditiva [Tesis de Grado en Medicina]. España: Universidad de Valladolid; 2016. Disponible en: http://uvadoc.uva.es/handle/10324/18808
- Xin L, Rajam P, Hui T, Faizatul R, Tan LJ. Analysis of paediatric cochlear implant candidacy: Single centre, retrospective observational study. Med J Malaysia [Internet]. 2022;77(2):143-149. Disponible en: https://www.e-mjm.org/2022/v77n2/paediatric-cochlear-implant.pdf
- Tekin A, Baelen H, Heuninck E, Bayazit Y, Mertens G,Van Rompaey V, et al. Evaluation of a Less Invasive Cochlear Implant Surgery in OPA1 Mutations Provoking Deafblindness. Genes [Internet]. 2023;14(3):627. doi: 3390/genes14030627
- Vandana V, Sankaran P, Nagappa M, Sinha S, Taly A. Audiological findings in Infantile Refsum disease. Int J Pediatr Otorhinolaryngol [Internet]. 2015;79(8):1366-1369. doi: 1016/j.ijporl.2015.05.023
- Manrique M, Zubicaray J, Ruiz de Erenchun I, Huarte A, Manrique-Huarte R. Guía Clínica para la indicación de implantes cocleares en la Comunidad Floral de Navarra. An Sist Sanit Navar [Internet]. 2015;38(2):289-296. Disponible en: https://scielo.isciii.es/pdf/asisna/v38n2/revision2.pdf
- Zheng D, Liu X. Cochlear Implantation Outcomes in Patients With OTOF Mutations. Front Neurosci [Internet]. 2020;14(447):1-7. doi: 3389/fnins.2020.00447
- Goswami J, Bruce I, Green K, O’Driscoll M. Cochlear implantation in a patient with sensori-neural deafness secondary to Charcot−Marie−Tooth disease. Cochlear Implants Int [Internet]. 2013;13(3):184-187. doi: 1179/1754762811Y.0000000021
- Stärh K, Kuechler A, Gencik M, Arnolds J, Dendy M, Lang S, et al. Cochlear Implantation in Siblings With Refsum’s Disease. An Otol Rhinol Laryngol [Internet]. 2017;126(8):611-614. doi: 1177/0003489417717269
- Nogueira C, Meehan T, O’Donoghue G. Refsum’s Disease and Cochlear Implantation. An Otol Rhinol Laryngol[Internet]. 2014;123(6):425-427. doi:1177/0003489414526846
- Kontorinis G, Lloyd S, Henderson L, Jayewardene-Aston D, Milward K, Bruce I, et al. Cochlear implantation in children with auditory neuropathy spectrum disorders. Cochlear Implants Int [Internet]. 2014;15(sup1):51-54. doi: 1179/1467010014Z.000000000157