Intervención paliativa del dolor mixto en el síndrome demencial avanzado. Maroto-Martínez M. y cols. ISSN 2215-5562. Rev. Ter. Enero-Junio de 2023; Vol. 17 N°1: 40-52.
ARTÍCULO DE REVISIÓN
Evaluación e intervención paliativa del dolor mixto en las personas con síndrome demencial avanzado
Evaluation and palliative intervention of mixed pain in people with advanced demential syndrome
Título corto: Intervención paliativa del dolor mixto en el síndrome demencial avanzado.
Autores: Melania Maroto-Martínez 1, Carlos Acuña-Aguilar 2, Marlene Roselló-Araya 3
Filiación: 1 Médico Máster en Cuidados Paliativos, independiente. Cartago, Costa Rica. 2 Director de la Maestría en Cuidados Paliativos, Universidad Santa Paula, San José, Costa Rica. 3 Instituto Costarricense de Investigación y Enseñanza en Nutrición y Salud-INCIENSA, Cartago, Costa Rica. Instituto de Investigación y Desarrollo Científico Académico-IIDCA, Universidad Santa Paula, San José, Costa Rica.
Correspondencia: Melania Maroto-Martínez, correo electrónico: melanimam@outlook.es
Forma de citar: Maroto-Martínez M, Acuña-Aguilar C, Roselló-Araya M. Evaluación e intervención paliativa del dolor mixto en las personas con síndrome demencial avanzado. Rev Ter [Internet]. 2023;17(1): 40-52.
Financiamiento: ninguno.
Conflicto de intereses: ninguno.
Fecha envío: 21 de noviembre del 2022.
Fecha de aceptación: 4 de enero del 2023.
Abreviaturas: CP, cuidados paliativos; SD, síndrome demencial; SDA, síndrome demencial avanzado; GDS, escala de deterioro global de Reisberg (por sus siglas en inglés).
Resumen
Objetivos: establecer la evaluación e intervención paliativa del dolor mixto en las personas con síndrome demencial avanzado, mediante el análisis de las escalas validadas e identificando las medidas farmacológicas y no farmacológicas basadas en estas escalas. Metodología: estudio descriptivo tipo revisión narrativa. La extracción de datos se obtuvo por medio de una revisión exhaustiva de artículos científicos seleccionados según el nivel de evidencia. Se utilizaron los motores de búsqueda Pubmed, Cochrane Library, Scielo, ELSEVIER, Revista Médica Británica, Biomed Central-Editorial científica británica. Se incluyeron artículos que relacionaran los temas de personas adultas con síndrome demencial y síndrome demencial avanzado y dolor, publicados en inglés y español, entre el 2006 y el 2022. Se excluyeron artículos que trataran de personas menores de edad con déficits cognitivos y de adultos con dolor mixto sin déficits cognitivos. Se utilizaron los siguientes descriptores: pain AND dementia, palliative care AND advanced dementia, dementia OR severe cognitive impairment, pain assessment AND scales. Se incluyen 26 artículos, entre los cuales se encontraron estudios de metaanálisis y revisión sistemática de ensayos clínicos aleatorizados para un 38,4%; revisión sistemática con homogeneidad de estudios de cohortes un 11,5%; estudios observacionales analíticos de cohortes y estudios observacionales descriptivos un 38,4%, y revisiones narrativas un 11,5%. Resultados y conclusiones: se determinó que las escalas validadas para la evaluación del dolor mixto en personas con síndrome demencial avanzado son principalmente PAINAD-Sp, escala de Abbey, MOBID-2, Mahoney, PADE y PACSLAC-2. Respecto a los tratamientos farmacológicos, el paracetamol, opioides, antiinflamatorios no esteroideos y neuromoduladores son los más usados. En las terapias no farmacológicas se recomienda la musicoterapia, sin embargo, las pruebas son escazas. En general, la evidencia debe seguir desarrollándose, a fin de que los futuros estudios clínicos se lleven a cabo con muestras más grandes y homogéneas.
Palabras claves: dimensión del dolor, escalas, tratamiento, demencia y cuidados paliativos.
Abstract
Objectives: to establish the evaluation and palliative intervention of mixed pain in people with advanced dementia syndrome, through the analysis of the validated scales and identifying the pharmacological and non-pharmacological measures based on these scales. Methods: descriptive study type narrative review. Data extraction was obtained through an exhaustive review of scientific articles selected according to the level of evidence. The search engines Pubmed, Cochrane Library, Scielo, ELSEVIER, British Medical Journal, Biomed Central-British Scientific Publishing House were used. Articles that related the topics of adults with dementia syndrome and advanced dementia syndrome and pain, published in English and Spanish, between 2006 and 2022, were included. Articles that dealt with minors with cognitive deficits and adults with cognitive deficits were excluded. mixed pain without cognitive deficits. The following descriptors were used: pain AND dementia, palliative care AND advanced dementia, dementia OR severe cognitive impairment, pain assessment AND scales. 26 articles are included, among which meta-analysis studies and systematic review of randomized experimental studies were found for 38.4%; systematic review with homogeneity of cohort studies 11.5%; analytical observational cohort studies and descriptive observational studies 38.4%, and narrative reviews 11.5%. Results and conclusions: it was determined that the validated scales for the evaluation of mixed pain in people with advanced dementia syndrome are mainly PAINAD-Sp, Abbey scale, MOBID-2, Mahoney, PADE and PACSLAC-2. Regarding pharmacological treatments, paracetamol, opioids, non-steroidal anti-inflammatory drugs and neuromodulators are the most used. Music therapy is recommended for non-pharmacological therapies, however the evidence is scant. In general, the evidence needs to continue to develop, so that future clinical studies are carried out with larger and more homogeneous samples.
Keywords: pain, therapeutics, scales, dementia, palliative care.
Introducción
Según Walsh1, la evaluación e intervención paliativa del dolor mixto en las personas con síndrome demencial avanzado (SDA) se ha convertido en un desafío para los equipos en Cuidados Paliativos (CP). El síndrome demencial (SD) es una patología relacionada con la senectud y las complicaciones de enfermedades sistémicas crónicas, el cáncer y las patologías degenerativas causantes de dolor mixto.
El cambio demográfico impacta en el auge del SD asociado a la presencia de dolor mixto. Como afirman Walsh1, la población mundial de personas adultas mayores (AM) crece rápidamente estimando un 2% anual principalmente en Asia, Latinoamérica y el Caribe. En el 2005, la población de adultos mayores superaba los 673 millones en todo el mundo y en el 2050 se espera que lleguen a 2.000 millones, situación epidemiológica que irá creando con el tiempo una imperiosa necesidad de atención integral de una población senil, con patologías como el SD y dolor crónico mixto.
En Latinoamérica, según los datos de la Organización de Naciones Unidas (ONU) publicados por el Banco Interamericano de Desarrollo (BID) en enero del 2018, la expectativa es que la población de AM pase del 11% actual al 25% en 35 años. Se valúan las diferencias de crecimiento para el 2050 y se espera que las Bahamas, Barbados, Brasil, Chile, Colombia, Costa Rica, Jamaica, Trinidad y Tobago y Uruguay lleguen a compararse con Alemania, Finlandia e inclusive Japón, con una proporción del 30%2 (figura 1).
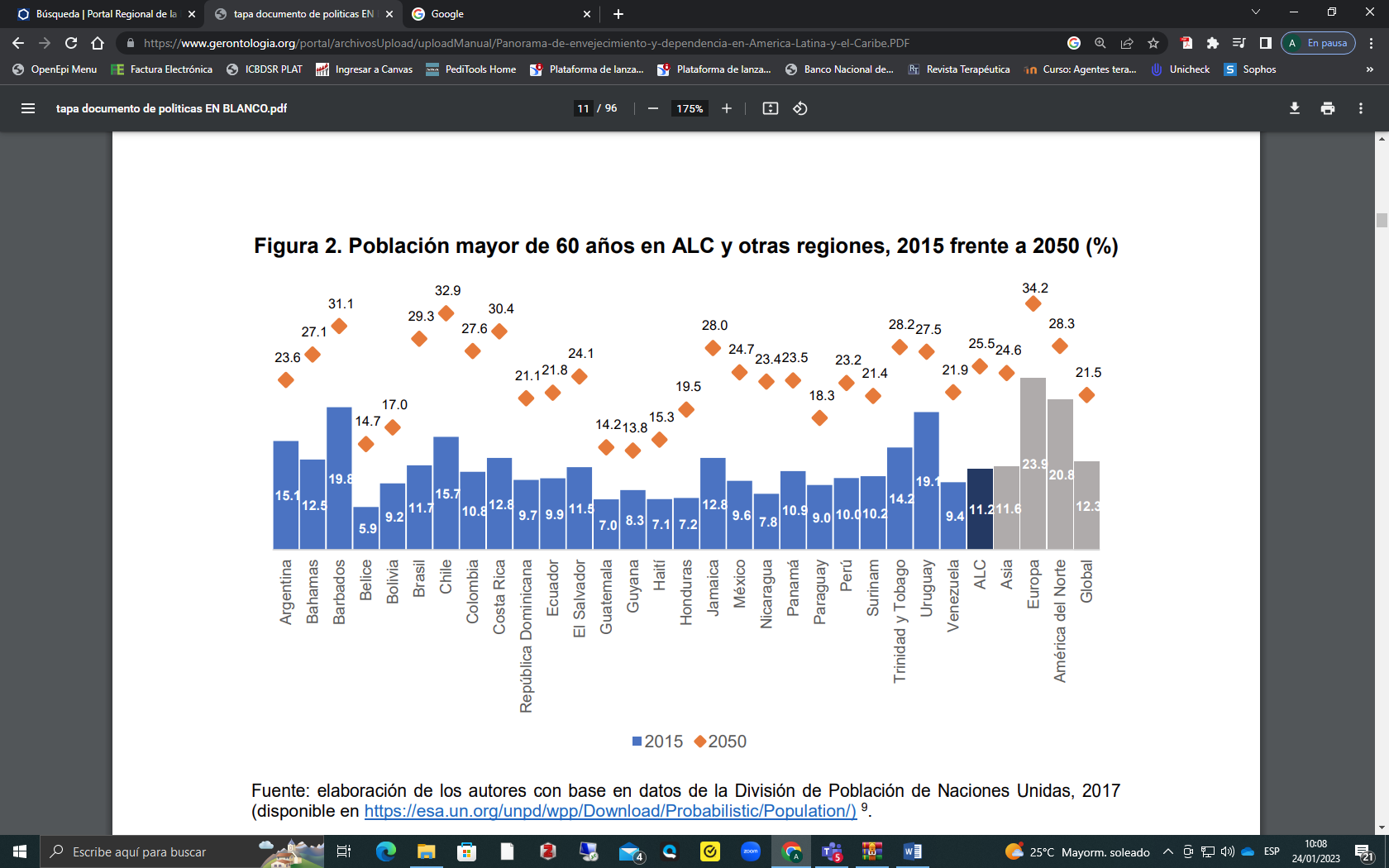
Figura 1. Población mayor de 60 años en América Latina y el Caribe, 2015 frente a 2050 (%)
Fuente: tomado de Aranco et al2 (https://www.gerontologia.org/portal/archivosUpload/uploadManual/Panorama-de-envejecimiento-y-dependencia-en-America-Latina-y-el-Caribe.PDF)
La demencia, según la Organización Mundial de la Salud (OMS)3 afecta a 50 millones de personas, 60% vive en países subdesarrollados (con carencia de atención paliativa y con sistemas de salud no universales ni solidarios). El concepto actual del SD, según el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares4, describe la pérdida de la función cognitiva (capacidad de pensar, razonar, recordar y resolver problemas), que interfieren con las actividades instrumentales de la vida diaria (AIVD), hasta imposibilitar las actividades básicas de la vida diaria (ABVD). Sus manifestaciones van de compromiso leve a severo de la autonomía y total dependencia de la persona enferma, además, repercuten en el desempeño familiar, laboral y social.
Las etiologías más frecuentes del SD son: a) enfermedades degenerativas, como enfermedad de Alzheimer (EA) (50-70%)1,5, demencia frontotemporal (5-10%)6 y demencia por cuerpos de Lewy (10-20%)7; b) demencia vascular (10-20%)5; c) demencia mixta.
Los criterios diagnósticos más usados para el SD están descritos en el Manual Diagnóstico y Estadístico de los Trastornos Mentales, número 58. En la tabla 1 se detallan los criterios diagnósticos del trastorno neurocognitivo mayor.
Tabla 1. Criterios diagnósticos del trastorno neurocognitivo mayor
|
Criterio |
Descripción |
|
A
|
Declive cognitivo sustancial desde un nivel previo de mayor desempeño en uno o más de los dominios cognitivos referidos: · Preocupación del individuo, de un tercero informado o del profesional con respecto a un declive sustancial de la cognición. · Caída en el desempeño neuropsicológico, implicando un desempeño en los test del rango de 2 o más desviaciones estándares por debajo de lo esperado en una evaluación neuropsicológica formal o ante una evaluación clínica equivalente. |
|
B |
Los déficits cognitivos son suficientes e interfirieren con la independencia de actividades básicas e instrumentales de la vida diaria. |
|
C |
Los déficits cognitivos no ocurren exclusivamente en el contexto de delirium. |
|
D |
Los déficits cognitivos no son atribuibles de forma primaria a la presencia de otros trastornos mentales. |
Fuente: tomado de Budinich et al9.
Budinich et al9 describen que el SD suele ser multifactorial y complejo, desarrollándose en personas vulnerables, expuestas a factores de riesgo modificables y no modificables, que se observan en la tabla 2. Este autor señala que las demencias se caracterizan por alteración de la atención, el lenguaje, pérdida de la orientación temporal, de la orientación espacial, de funciones ejecutivas, de la percepción, presencia anosognosia, praxias y trastorno de la memoria (olvidos patológicos, en especial la memoria episódica desde lo reciente hasta lo remoto, semántica y menos la memoria procedural), no siempre el deterioro es global ni siempre afecta la memoria. Además, se desarrollan manifestaciones neuropsiquiátricas afectivas y psicóticas.
Tabla 2. Factores de riesgos modificables y no modificables, para desarrollar síndrome demencial
|
Factores modificables |
Descripción |
|
Depresión |
En adultos mayores hay mayor riesgo o la depresión per se puede ser un síntoma temprano de demencia. |
|
Estilos de vida |
Los estilos de vida que afectan principalmente la salud cardiovascular como: el sedentarismo, tabaquismo, obesidad, consumo excesivo de alcohol y los traumas de cráneo. |
|
Escolaridad y nivel socioeconómico bajo |
La escolaridad formal temprana, favorece la reserva cognitiva y compensa las posibles pérdidas debidas al proceso de envejecimiento o potencial deterioro secundario a la enfermedad. Las desigualdades socioeconómicas propician menor desempeño cognitivo. |
|
Déficit auditivo |
Este factor aunado a la depresión, al aislamiento social, a la relación del procesamiento auditivo con las zonas prefrontales y temporales del cerebro. |
|
Aislamiento social y soledad |
Esta alteración de la salud mental tiene un comportamiento similar a la depresión. |
|
Factores no modificables |
Como la proteína precursora del amiloide, las presenilinas y apolipoproteína E. |
Fuente: tomado de Budinich et al9.
Según Budinich et al9 las escalas más explícitas para ubicar a la persona enferma en una etapa leve, moderada o avanzada del SD corresponden a la Escala del Minimental, la Clasificación Clínica de la Demencia y la escala de deterioro global de Reisberg (GDS, por sus siglas en inglés). La escala GDS9 precisa 7 grados de déficit: el número 1 es un estadío normal, en el 2 hay una disminución cognitiva muy leve; en el 3 hay una pérdida cognitiva leve, en el 4 un deterioro cognitivo moderado, en el 5 un deterioro cognitivo moderado-severo, en el 6 un deterioro cognitivo grave y el grado 7 un deterioro cognitivo grave con un síndrome afaso/apráxico/agnósico, es decir, un SDA.
En la etapa avanzada del SD hay una pérdida completa de la autonomía, de la funcionabilidad y dependencia completa de la persona enferma, con mayor demanda de intervención paliativa y cuidados de la red de apoyo. Se utiliza la Estatificación de la Evaluación Funcional, se subdivide para evaluar mejor la etapa de demencia severa en las fases GDS 6 y GDS 7 descritas en la tabla 3.
Tabla 3. Criterios para determinar la demencia terminal según Organización Nacional de Hospicios
|
Estado funcional |
|
A. Los pacientes en una fase severa pueden tener pronóstico superior a 2 años. La supervivencia dependerá de comorbilidades y cuidados. B. Estadío 7 o superior según escala de evaluación funcional. C. El paciente deberá presentar: c.1 Incapaz de caminar sin ayuda. c.2 Incapaz de vestirse sin ayuda. c.3 Incapaz de bañarse correctamente. c.4 Incontinencia urinaria y fecal. -Ocasionalmente o muy frecuente, en las últimas semanas. -Información aportada por un cuidador. c.5 Incapaz de hablar o comunicarse con sentido. -Habla limitada a media docena de palabras o menos en el curso 24 horas o durante una entrevista intensiva. |
|
Presencia de complicaciones médicas A. Presencia de comorbilidades médicas lo suficientemente severas para requerir tratamiento en el último año, si han sido tratadas o no, disminuyen la supervivencia en la demencia terminal. B. Comorbilidades: b.1 Neumonía por aspiración. b.2 Pielonefritis u otras infecciones del tracto urinario superior. Septicemia. b.3 Úlceras por presión, múltiples, estadio 3-4. b.4 Fiebre recurrente después de antibióticos. C. Dificultad en la ingesta o rechazo de comida, severa para la persona no pueda mantener un aporte correcto para vivir, una pérdida de peso > 10% durante los seis meses previos o una albúmina < 2,5mg/dl. |
|
|
Fuente: tomado de Formiga et al10.
Una dificultad en el SDA es la evaluación del dolor y se reporta que “al menos el 50% de las personas con demencia también experimentan regularmente dolor”11; se describe con un componente mixto, relacionado al sistema musculoesquelético (por ejemplo, la osteoartritis), producido por caídas, úlceras por presión, infecciones y neuropatía subyacente.
Según Varela12, el dolor en SDA es infra-diagnosticado, infra-tratado y las personas enfermas reciben menos tratamiento analgésico, sobre-prescripción de antipsicóticos y se ofrecen pocas medidas no farmacológicas para su control, produciendo deterioro de la calidad de vida. Según Husebo et al13, debido a que la fisiopatología del dolor cambia, el autoinforme está ausente y el tratamiento debe adaptarse a esta incapacidad de informar y expresar dolor.
Alaba et al14 describen que en el SD no se observan cambios en el umbral de respuesta al dolor, sino en la tolerancia de este. El componente sensitivo está íntegro y el componente afectivo del dolor modificado como pasa en la demencia vascular por desaferenciación. En la enfermedad de Alzheimer hay depósito de beta amiloide y proteína tau hiperfosforilada en la corteza entorrinal, amígdala e hipocampo, se altera la modulación y regulación del dolor, se reduce la respuesta autonómica con estímulos umbral, normalizándose la respuesta solo con estímulos más intensos. En la demencia frontotemporal hay reducción del procesamiento, del componente emocional y mayor tolerancia al dolor.
La evaluación del dolor se realiza mediante las escalas de autoinforme, sin embargo, en el SDA no son aplicables, por lo que se prefieren las escalas observacionales. Lichtner et al11 se basan en las guías publicadas por la Sociedad Americana de Geriatría y presentan seis dominios para evaluar el dolor: expresión facial, vocalización negativa, lenguaje corporal, cambios en los patrones en la actividad, cambios en las interacciones interpersonales y en el estado mental.
El objetivo de este artículo es analizar las escalas que se encuentran validadas para la evaluación del dolor mixto en personas con síndrome demencial avanzado e identificar las medidas farmacológicas y no farmacológicas basadas en las escalas para el control del dolor mixto en las personas con síndrome demencial avanzado.
Metodología
Estudio descriptivo tipo revisión narrativa. Se utilizaron fuentes de información primaria y secundaria, por medio de bases de datos, artículos científicos, documentos oficiales de páginas como la OMS, OPS, SECPAL, CCSS, Ministerio Salud Pública de Costa Rica y el INEC. Además, se incluyeron algunas revisiones de tesis doctorales y libros referentes a la temática expuesta.
Se utilizaron los motores de búsqueda Pubmed, Cochrane Library, revistas como Scielo, ELSEVIER, BMJ (Revista Médica Británica), BMC (Biomed Central-Editorial científica británica). Los descriptores utilizados en la búsqueda fueron: dolor, evaluación del dolor, escalas de dolor, tratamiento del dolor, demencia, demencia avanzada y cuidados paliativos. Como criterios de inclusión se priorizaron artículos que hablaran de personas adultas con síndrome demencial, SDA y dolor; artículos publicados en idioma inglés y español, publicados entre el 2015 y el 2021. Se excluyeron aquellos que incluyeran personas jóvenes con déficits cognitivos adultos con dolor mixto sin déficits cognitivos. Se encontraron un total de 108 artículos, se revisaron por títulos, se descartaron duplicados, luego se seleccionaron según criterios de inclusión y exclusión a través de la revisión de los resúmenes; por último, se realizó la revisión de cada uno de los artículos seleccionados en texto completo. Se incluyeron 26 artículos, los cuales contaron con un adecuado nivel de evidencia científica. Según la clasificación de Sackett; los estudios que se encontraron tipo metaanálisis y revisión sistemática de ensayos clínicos, además de estudios experimentales aleatorizados para un 38,4%; revisión sistemática con homogeneidad de estudios de cohortes un 11,5%; estudios observacionales analíticos de cohortes y estudios observacionales descriptivos un 38,4%, y revisiones narrativas un 11,5%.
Discusión de resultados
Evaluación del dolor mixto en personas con SDA
Las escalas validadas para la evaluación del dolor mixto en personas con SDA, según Malara et al15, se basan en la evaluación del comportamiento no verbal, por ejemplo, vocalizaciones negativas, muecas, suspiros, llanto, parpadeos rápidos, movimientos, agitación, rigidez, deambular, habla verbal inapropiada, agresión, ansiedad y zozobra. Por lo tanto, Ellis-Smith et al16 afirman que los requisitos para la escogencia de las escalas de diagnóstico del dolor es que sean válidas y confiables, respondan a cambios clínicamente interpretables, con mínima formación académica para su aplicación, breves y fáciles de utilizar.
En la tabla 4, se muestran las distintas escalas observacionales del dolor descritas para utilizarse en síndromes demenciales y déficits cognitivos.
En general, la evaluación e intervención paliativa del dolor mixto en las personas con SDA es un tema poco explorado en América Latina y aún menos en Costa Rica. La necesidad es establecer métodos de diagnóstico estandarizados, validados, fáciles de aplicar para los profesionales en CP y los cuidadores. Como asegura Bullock et al17, el reconocimiento oportuno del dolor en esta población garantiza un tratamiento eficaz y reduce los efectos de la medicación.
Tabla 4. Escalas observacionales del dolor para utilizar en síndromes demenciales y déficit cognitivo
|
Escala |
Características |
|
Escala Doloplus-218-21 |
Evalúa dolor en adultos mayores con dificultades de comunicación verbal. Cuenta con 10 elementos (5 somáticos, 2 psicomotores y 3 psicosociales, cada uno puntuado de 0-3). Puntuación ≥5 sobre 30, indica dolor fuerte. |
|
Escala CNPI18, 21 |
Evalúa comportamientos asociados al dolor en adultos mayores con deterioro cognitivo severo. Tiene 6 categorías: quejas vocales no verbales, muecas faciales, apoyo corporal durante el movimiento, inquietud, frotamientos y quejas vocales verbales. |
|
Escala PAINAD/PAINAD-Sp18, 19, 21 |
Valora el dolor en personas con síndrome demencial avanzado. Consta de 5 elementos de medición: respiración, vocalización negativa, expresión facial, lenguaje corporal y capacidad de alivio. Cada ítem tiene calificación máxima de 2. Las puntuaciones son 0=sin dolor a 10=máximo dolor equivalente a la escala visual analógica del dolor. |
|
Escala PADE18, 21
|
Valora el dolor en individuos con síndrome demencial avanzado. Compuesta por 3 secciones, el primero es componentes físicos: expresión facial observable, patrón de respiración y postura. La calificación de la intensidad del dolor es el segundo componente y el último incluye evaluaciones de actividades básicas de vida diaria. |
|
Escala APS18, 19, 21 |
Evalúa el dolor en síndrome demencial avanzado. Cubre 6 dominios: vocalización, expresión facial, lenguaje corporal, cambios de comportamiento, cambios fisiológicos y cambios físicos. |
|
Instrumento NOPPAIN 18, 21 |
Aplicada por enfermería, valora comportamientos de dolor en personas con síndrome demencial, tanto en reposo como en movimiento. Consta de 4 secciones: comportamiento del dolor, condiciones de cuidado e intensidad del dolor. |
|
Escala MOBID-221 |
Evalúa el dolor en personas SD moderado a grave. Enfatiza 3 signos relacionados con el movimiento: expresiones faciales, ruidos de dolor y gestos defensivos. |
|
Escala Mahoney21 |
Evalúa la severidad del dolor en SDA, diferencia el dolor de la agitación. La aplican los cuidadores. Tiene 8 elementos clasificados en una escala de 4 puntos (0-3), el 0=dolor mínimo y 3=severo. Valoran comportamientos de dolor comunes: expresiones faciales, vocalizaciones, lenguaje corporal y cambios de respiración. |
|
Escala EDAD19, 21 |
Valora el dolor en adultos mayores con demencia grave, aplicada por personal sanitario de cuidado habitual sin capacitación. |
Fuentes: tomado Zwakhalen et al18, de Juan Pardo et al19, Peralta20 y Pautex et al21.
Los beneficios son múltiples para muchas poblaciones, por ejemplo, según Zwakhalen et al18, al desarrollar una herramienta para evaluar el dolor se puede mejorar en un 20-30% la calidad de vida y suplir las necesidades de las personas con SD.
Los cuidadores y las familias se favorecen al sentir menos angustia y reducción de la carga laboral. Como afirman De Juan Pardo et al19, la unión del dolor y la demencia constituye una de las causas más frecuentes de sufrimiento, discapacidad y afecta enormemente la calidad de vida de las personas que la padecen, la de sus cuidadores o familiares.
Los profesionales en CP se favorecen, según Lichtner et al11, porque los equipos de atención paliativa causan impacto positivo en términos de elección del tratamiento paliativo y la respuesta de la persona enferma, lo que se traduce en reducción de la carga laboral.
Los gobiernos se ven favorecidos, según Zamora-Mur et al7 y De Juan Pardo et al19, con la reducción del gasto en la salud pública. La unión de la demencia y el dolor aumentan los costos sanitarios, pues agravan el deterioro cognitivo, la funcionabilidad y se pueden prolongar las estancias hospitalarias.
Las escalas observacionales descritas en la tabla 4, se analizaron y aquellas con mejores índices de fiabilidad (respecto a concordancia interna, fiabilidad entre 2 evaluadores, coeficiente de correlación intraclase, fiabilidad test-retest) y validez (en relación con validez concurrente, validez de contenido, validez de constructo, validez convergente y validez discriminante) para la evaluación del dolor en personas con síndromes demenciales y déficits cognitivos son: PAINAD-Sp (2014), Abbey (2013), MOBID-2 (2010), Mahoney (2008), PADE (2003), y PACSLAC-2 (2007).
Como afirman De Juan Pardo et al19, la escala que más se adecua al escenario domiciliar actual y que los cuidadores la pueden aplicar en el hogar es la escala de PAINAD-Sp, pues requiere un adiestramiento básico para los cuidadores.
Intervención farmacológica para el control de dolor mixto en SDA
Las medidas farmacológicas basadas en las escalas para el control del dolor mixto en las personas con SDA han cambiado con el tiempo. Según Erdal et al22, el uso de analgésicos ha incrementado en la última década, en especial el uso de opioides con el consiguiente alto potencial de efectos secundarios. Se encontró un aumento de un 11% en el 2000, a un 24%, en el 2011; en especial, en el consumo de opioides fuertes pasó del 1,9% al 17,9%. Se identificaron fármacos utilizados para el dolor en personas con SD, como se especifica en la tabla 5.
Bullock et al17 aseveran que el paracetamol fue usado más comúnmente en un 23%, seguido de los AINE (12%) y los opioides (14,3%), (9,8%=opioides débiles y un 5,3%=opioides fuertes siendo más recetados el fentanilo y la buprenorfina, las presentaciones en parches transdérmicos para personas con dificultades para deglutir, función gastrointestinal menoscabada o falta de apego al tratamiento).
Sørensen et al23 afirman que los opioides son más recetados, seguidos por fármacos como el acetaminofén, la pregabalina y los AINE. Por su parte, Husebo et al24 aseguran, después de la intervención de la conducta agitada mediante el manejo del dolor (usando la escala MOBID-2) durante 8 semanas, que los fármacos más usados fueron el acetaminofén oral, la morfina de liberación prolongada vía oral (un máximo de 20mg/día), el parche transdérmico de buprenorfina y la pregabalina (un máximo de 300mg/día) dosis fija.
De acuerdo con Husebo et al24, hubo mejoría de síntomas como respuesta al tratamiento del dolor en el estado de ánimo como depresión, apatía y ansiedad en las personas con SD. Según van Dam et al26 sobre la calidad de vida y el uso de analgésicos en persona con SDA, el 54,1% usaba paracetamol, 32,7% usaba 1 o más opioides juntos, un 25% usaba paracetamol y opioides juntos. Así se definió que el 62% empleaba paracetamol, opioides o ambos.
Tabla 5. Fármacos usados en personas con dolor, síndrome demencial y su seguridad
|
Fármaco |
Resultado |
|
Acetaminofén
|
El medicamento es bien tolerado, inclusive dosis de 3 g por día. |
|
Antinflamatorios no esteroideos (AINE) |
La indometacina se asoció a mayor riesgo de efectos gastrointestinales, aumento de creatinina y accidente cerebrovascular. El diclofenaco con misoprostol reportó dolor abdominal, neutropenia leve, alteración del comportamiento. La nimesulida produjo alteraciones de niveles hepáticos, estreñimiento, estado de ánimo elevado, malestar abdominal y erupciones cutáneas. El naproxeno reportó mareos, fatiga, sequedad de boca e hipertensión. El celecoxib evidenció disnea, incontinencia urinaria, hipertensión arterial. Demostraron eficacia analgésica y seguridad en general. |
|
Opioides |
Oxicodona dosis única no demostró eventos adversos. Oxicodona o morfina por 4 semanas, demostró eventos adversos y retiro equilibrado. Buprenorfina en parche, produjo efectos neuropsiquiátricos y se suspendió su uso. |
Fuente: elaboración propia, basada en Erdal et al22.
Rajkumar et al27 aseguran que en una población de 967 personas con SD que vivía en 67 residencias de personas adultas mayores, el 35,3% tenían dolor según la escala APS, y con el tratamiento de paracetamol, AINE; opioides, gabapentina, analgesia tópica desde el inicio del estudio, se documentó reducción significativa del dolor y sus manifestaciones conductuales.
van Kooten et al28 alegan que en 199 participantes la prevalencia del dolor fue de un 43% usando la escala del dolor MOBID-2, el fármaco más utilizado fue el acetaminofén en un 80%, la oxicodona en un 6,6% y los parches de fentanilo en un 6,6%.
Es difícil valorar el riesgo beneficio de la intervención farmacológica en estos pacientes, por ser generalmente personas con múltiples patologías y polifarmacia, factores que reducen la validez externa y por esto, generalmente, son excluidos de los ensayos clínicos.
De los estudios analizados, se identifica que los medicamentos más recomendados, solos o combinados, son: paracetamol, opioides (morfina, oxicodona, buprenorfina, fentanilo), AINES y neuromoduladores (gabapentina y pregabalina)21-28.
Intervención no farmacológica para el control de dolor mixto en SDA
Las medidas no farmacológicas para el control del dolor mixto en las personas con SDA son variadas. Walsh1 explican que terapias conductuales, la musicoterapia, los ejercicios y la valoración del medioambiente favorecen el alivio del dolor. Asimismo, algunas alternativas terapéuticas que evitan el inmovilismo y dolor son las descritas por Alaba et al14 como cinesiterapia y termoterapia.
Bullock et al17 determinaron que la intervención musical en el control del dolor en las personas enfermas antes y después de escuchar melodías redujo el dolor después de escucharlas y no antes. Terapias como el reiki y la reflexología han demostrado mejoría del dolor, aunque con poca evidencia.
Solsona29 describe que la musicoterapia ha demostrado mejoría de síntomas en la percepción del dolor, ansiedad, estado de ánimo, la respiración, es efectiva y valida en personas con SDA.
Liu30 alega disminución en la puntuación media del dolor, con el uso de almohadillas calientes, terapia de hielo, masajes, estimulación nerviosa eléctrica transcutánea y la acupuntura.
Como afirma González et al31, crear un ambiente confortable para la persona enferma que incluya, por ejemplo, aromaterapia, musicoterapia, cambios de postura, fisioterapia y acompañamiento, se relaciona con la reducción del dolor. Incluso mediante programas de yoga y el taichí se obtuvo una reducción media de la puntuación del dolor en un 23%. De la misma forma, se determina que la efectividad de estos enfoques se incrementará si se combinan dos o más terapias.
Como alega Ciprés 32, algunas intervenciones como la fisioterapia, la rehabilitación, la osteopatía, acupuntura, aromaterapia, fitoterapia, homeopatía y medicina ayurvédica son eficaces para tratar el dolor crónico en personas con SD.
Las medidas antes mencionadas demuestran mejoría clínica en el control del dolor, siempre que se integren con los tratamientos farmacológicos, pero se necesitan más estudios, muestras más grandes y por periodos prolongados para cuantificar la eficacia de estas terapias alternativas.
Conclusión
En general, la evidencia debe seguir desarrollándose, y es necesario que se realice mayor investigación de estas escalas para la evaluación del dolor respecto a la capacidad de respuesta y la interpretabilidad.
Respecto a los tratamientos no farmacológicos, se necesitan más estudios acerca de la seguridad y tolerabilidad de los medicamentos, la evidencia experimental propone que las personas con demencia podrían requerir más analgesia para alcanzar un adecuado alivio del dolor. La evidencia en el uso de la terapia no farmacológica ha sido muy limitada, son estudios que no cuentan con cualidades psicométricas, ni mediciones de fiabilidad o validez.
Se recomienda formar a los profesionales en ciencias de la salud que realizan intervención paliativa, en la aplicación de las escalas validadas para el diagnóstico del dolor mixto en personas con SDA. Se debe incentivar a los profesionales en cuidados paliativos para entrenar a los cuidadores y/o familiares en el uso de las escalas validadas para la evaluación del dolor mixto en personas con SDA. Que los profesionales competentes puedan instruir a los familiares y/o cuidadores en la utilización de los medicamentos más recomendados para el tratamiento del dolor mixto en personas con SDA, respecto a: conocer el tipo de analgesia, efectos esperados del fármaco, efectos adversos, interacciones medicamentosas e interpretación a través del lenguaje no verbal. Respecto al tratamiento no farmacológico que el personal que labora en cuidados paliativos capacite a los cuidadores y/o familiares sobre las diversas terapias no farmacológicas que mejoran el dolor mixto en personas con SDA.
Estas recomendaciones deberían tomarse en cuenta en la atención paliativa y ser prioridad para mejorar el confort, la calidad de vida y calidad de muerte de las personas con SDA, asimismo procurar el bienestar integral de la familia y los cuidadores.
Referencias bibliográficas
- Walsh D. Medicina Paliativa. Primera edición. Barcelona: Elsevier; 2019.
- Aranco N, Stampini M, Ibarrarán P, Medellín N. Panorama de envejecimiento y dependencia en América Latina y el Caribe. BID; 2018. Disponible en: https://www.gerontologia.org/portal/archivosUpload/uploadManual/Panorama-de-envejecimiento-y-dependencia-en-America-Latina-y-el-Caribe.PDF
- Organización Mundial de la Salud [Internet]. Washington: OMS; 2020 [citado el 14 de abril de 2021]. Demencia [aprox. 6 pantallas]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/dementia
- Instituto Nacional de Trastornos Neurológicos y Accidentes Vasculares [Internet]. Estados Unidos: NIH; 2022 [citado el 23 de julio de 2021]. Demencia [aprox. 3 pantallas]. Disponible en: https://espanol.ninds.nih.gov/es/trastornos/demencia
- Zurique Sánchez C, Cadena Sanabria MO, Zurique Sánchez M, Camacho López PA, Sánchez Sanabria M, Hernández Hernández S, et al. Prevalencia de demencia en adultos mayores de América Latina: revisión sistemática. Rev Esp Geriatr Gerontol [Internet]. 2019 [citado el 22 de julio de 2021];54(6):346-355. doi: 10.1016/j.regg.2018.12.007.
- Gutiérrez Pantoja MA, Valdés Fernández B, Cordido Henríquez F, Anguita Martínez G, Vallejo Desviat P, Molina López-Nava P. Enfermedad neurodegenerativa: demencia frontotemporal. Sanid mil [Internet]. 2020 [citado el 27 de julio de 2021];76(1):39-40. doi: 10.4321/S1887-85712020000100008.
- Zamora-Mur A, Zamora-Catevilla A, García-Foncillas R, Aubí-Catevilla Ó, Nabal-Vicuña M. Atención domiciliaria especializada en pacientes con demencia. Med Paliat [Internet]. 2018 [citado el 22 de julio de 2021];25(1):22-29. doi: 10.1016/j.medipa.2016.04.001.
- Asociación Americana de Psiquiatría. Manual diagnóstico y estadístico de los trastornos mentales DSM-5. 5a ed. Madrid: Editorial Médica Panamericana; 2014.
- Budinich M, Aravena JM, Gajardo J, Fuentes P. Demencias: una mirada biopsicosocial. Chile; 2019.
- Formiga F, Robles MJ, Fort I. Demencia, una enfermedad evolutiva: demencia severa. Identificación de demencia terminal. Rev Esp Geriatr Gerontol [Internet]. 2009 [citado el 21 de agosto de 2021];44(S2):2-8. doi: 10.1016/j.regg.2009.05.009.
- Lichtner V, Dowding D, Esterhuizen P, Closs SJ, Long AF, Corbett A, et al. Pain assessment for people with dementia: a systematic review of systematic reviews of pain assessment tools. BMC Geriatr [Internet]. 2014 [citado el 28 de julio de 2021];14(1):138. doi: 10.1186/1471-2318-14-138.
- Varela Vega P. ¿Podemos medir el dolor en personas con demencia moderada y severa? [Tesis de Grado en Enfermería] País Vasco: Universidad del País Vasco; 2018. Disponible en: https://addi.ehu.es/bitstream/handle/10810/27809/TFG_Varela.pdf?sequence=3#:~:text=Este%20resultado%20sugiere%20que%20las,dependientes%20del%20personal%20de%20enfermer%C3%ADa.
- Husebo BS, Kerns RD, Han L, Skanderson M, Gnjidic D, Allore HG. Pain, Complex Chronic Conditions and Potential Inappropriate Medication in People with Dementia. Lessons Learnt for Pain Treatment Plans Utilizing Data from the Veteran Health Administration. Brain Sci [Internet]. 2021 [citado el 22 de julio de 2021];11(1):86. doi: 10.3390/brainsci11010086.
- Alaba J, Arriola E, Navarro A, González MF, Buiza C, Hernández C, et al. Demencia y dolor. Rev Soc Esp Dolor [Internet]. 2011 [citado el 22 de julio de 2021];18(3):176-186. Disponible en: https://scielo.isciii.es/pdf/dolor/v18n3/revision1.pdf
- Malara A, De Biase GA, Bettarini F, Ceravolo F, Di Cello S, Garo M, et al. Pain Assessment in Elderly with Behavioral and Psychological Symptoms of Dementia. J Alzheimers Dis [Internet]. 2016 [citado el 19 de octubre de 2021];50(4):1217-1225. doi: 10.3233/JAD-150808.
- Ellis-Smith C, Evans CJ, Bone AE, Henson LA, Dzingina M, Kane PM, et al. Measures to assess commonly experienced symptoms for people with dementia in long-term care settings: a systematic review. BMC Med [Internet]. 2016 [citado el 22 de julio de 2021];14:38. doi: 10.1186/s12916-016-0582-x.
- Bullock L, Bedson J, Jordan JL, Bartlam B, Chew‐Graham CA, Campbell P. Pain assessment and pain treatment for community‐dwelling people with dementia: A systematic review and narrative synthesis. Int J Geriatr Psychiatry [Internet]. 2019 [citado el 22 de julio de 2021];34(6):807-821. doi: 10.1002/gps.5078.
- Zwakhalen SM, Hamers JP, Abu-Saad HH, Berger MP. Pain in elderly people with severe dementia: a systematic review of behavioural pain assessment tools. BMC Geriatr [Internet]. 2006 [citado el 20 de julio de 2021];6(1):3. doi: 10.1186/1471-2318-6-3.
- de Juan Pardo MÁ, Saracibar-Razquin M, Crespo I, Fuster Linares P. Valoración del dolor en personas con demencia y problemas de comunicación en España. Revisión sistemática. Rev Clín Esp [Internet]. 2018 [citado el 22 de julio de 2021];218(8):435-444. doi: 10.1016/j.rce.2018.05.002.
- Peralta Peralta JL. Valoración del dolor en el paciente con deterioro cognitivo. [Tesis de Grado en Enfermería] España: Universitat JAUME I; 2017 [citado el 10 de octubre de 2021]. Disponible en: https://repositori.uji.es/xmlui/bitstream/handle/10234/174574/TFG_2017_Peralta_Peralta_Julieta_Lidia.pdf?sequence=1&isAllowed=y
- Pautex S, Michon A, Guedira M, Emond H, Le Lous P, Samaras D, et al. Pain in severe dementia: self-assessment or observational scales? J Am Geriatr Soc [Internet]. 2006 [citado el 10 de octubre de 2021];54(7):1040-1045. doi: 10.1111/j.1532-5415.2006.00766.x.
- Erdal A, Ballard C, Vahia IV, Husebo BS. Analgesic treatments in people with dementia - how safe are they? A systematic review. Expert Opin Drug Saf [Internet]. 2019 [citado el 12 de febrero de 2022];18(6):511-522. doi: 10.1080/14740338.2019.1614166.
- Sørensen AMS, Tarp S, Johannsen P, Lolk A, Bandak E, Pedersen H, et al. Analgesics use and withdrawal in people with dementia – a register - based Danish study and a systematic review. Dan Med J [Internet]. 2019 [citado el 13 de febrero de 2022];66(12):A5578. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31791478/
- Husebo BS, Ballard C, Cohen-Mansfield J, Seifert R, Aarsland D. La respuesta del comportamiento agitado al manejo del dolor en personas con demencia. El Diario Americano del Psiquiatría y Geriatría. 2013. [Citado 13 de febrero del 2022]; 22(7); 708-17. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1064748112001030.
- Husebo BS, Ballard C, Sandvik R, Nilsen OB, Aarsland D. Efficacy of treating pain to reduce behavioural disturbances in residents of nursing homes with dementia: cluster randomised clinical trial. BMJ [Internet]. 2011 [citado el 12 de febrero de 2022];343:d4065. doi: 10.1136/bmj.d4065.
- van Dam PH, Caljouw MAA, Slettebø DD, Achterberg WP, Husebo BS. Quality of Life and Pain Medication Use in Persons With Advanced Dementia Living in Long-Term Care Facilities. J Am Med Dir Assoc [Internet]. 2019 [citado el 18 de febrero de 2022];20(11): 1432-1437. doi: 10.1016/j.jamda.2019.02.019.
- Rajkumar AP, Ballard C, Fossey J, Orrell M, Moniz-Cook E, Woods RT, et al. Epidemiology of Pain in People with Dementia Living in Care Homes: Longitudinal Course, Prevalence, and Treatment Implications. J Am Med Dir Assoc [Internet]. 2017 [citado el 18 de febrero de 2022];18(5):453.e1-453.e6. doi: 10.1016/j.jamda.2017.01.024.
- van Kooten J, Smalbrugge M, van der Wouden JC, Stek ML, Hertogh CMPM. Prevalence of Pain in Nursing Home Residents: The Role of Dementia Stage and Dementia Subtypes. J Am Med Dir Assoc [Internet]. 2017 [citado el 18 de febrero de 2022];18(6):522-527. doi: 10.1016/j.jamda.2016.12.078.
- Solsona Belmonte R. Musicoterapia para personas mayores con demencia avanzada. Impacto socioemocional y calidad de vida. Rev Inv Musicoter [Internet]. 2021 [citado el 24 de febrero de 2022];5(1):43-53. doi: 10.15366/rim2021.5.003%20.
- Liu JY, Lai C. Implementation of observational pain management protocol to improve pain management for long-term institutionalized older care residents with dementia: study protocol for a cluster-randomized controlled trial. Trials [Internet]. 2014 [citado el 13 de febrero de 2022];15(1):78. doi: 10.1186/1745-6215-15-78.
- González Vaca J, García Hernández M, Tortosa i Moreno A. El dolor en personas con demencia moderada o severa: revisión narrativa. Gerokomos [Internet]. 2020 [citado el 22 de febrero de 2022];31(3):144-148. doi: 10.4321/s1134-928x2020000300005.
- Ciprés Alastuey T. Valoración y tratamiento no farmacológico del dolor en personas mayores con demencia moderada/severa: revisión sistemática. [Tesis de Maestría en Gerontología Social] España: Universidad de Zaragoza; 2020 [citado el 22 de febrero de 2022]. Disponible en: https://zaguan.unizar.es/record/98553/files/TAZ-TFM-2020-885.pdf